UNIDAD SEIS
EXPRESIONES GENERALES.
Gas Ideal o Perfecto
Es cualquier gas que cumple con las leyes de Boyle, Charles y Gay- Lussac y no sufre alteraciones en su estructura química por cambios de presión y temperatura.
Teoría Cinética
Es una teoría de la relación entre el calor y el movimiento. De acuerdo a la teoría cinética la temperatura de una sustancia es una medida de energía cinética promedio de las moléculas que forman las sustancias. Al aplicar esta teoría se asume que:
1. Los gases se componen de moléculas que poseen movimientos rápidos.
2. El espacio entre las moléculas es tan grande que podemos decir que el volumen ocupado por moléculas del gas es muy pequeño.
3. La energía cinética promedio de las moléculas en los gases es proporcional a la temperatura (0 K). A una temperatura determinada todos los-gases tienen la misma Energía Cinética promedio. 4. Las moléculas están muy separadas y se mueven rápidamente por la que las fuerzas de atracción son mínimas.
Presión
"Es la fuerza que actúa por unidad de superficie. La presión atmosférica normal es la presión ejercida por una atmósfera sobre el nivel del mar, en condiciones climáticas normales. Barómetro
Equivalencia de Presión
PRESION=Fuerza/ Newton)/Area (m2)
1 atm = 760 mm Hg 1 atm= 76 cm Hg
1 atm= 1033.22.g/cm2
1 atm- 14.71b/pulg2
1 atm= 33.9 pies de columna de agua
1 atm = 10.33 m de agua latm=10,013:<105
atm =" 29.9"
atm="l.03323" atm=" 1.01325"
atm=" 760" guayaquil="120Torr" quito=" 90" guayaquil="?
dinas/cm2" quito="?dinas/cm2"
atm=" 760"
atm=" 1.01325"
cm2 ="159000"
n =" C-0" 273 =" F-32"
ESTADO GASEOSO
 Propiedades
Propiedades
1 Las moléculas en los gases se encuentran separados por grandes espacios intermoleculares
2 Las moléculas en los gases poseen movimientos constantes y desordenados
3. Los gases son muy compresibles, es decir, pueden disminuir fácilmente el volumen por efecto de fuerzas externas
4. Los gases carecen de volumen y siempre tratan de ocupar el mayor espacio posible
5 Los gases carecen de forma propia y adoptan las del recipiente que las contiene
6 Las moléculas de los gases se mezclan fácilmente con moléculas de otros gases.
Leyes que Rigen el Comportamiento Físico de los Gases
Expresiones utilizadas
Volumen
Es el espacio ocupado por la muestra, debido a las bajas densidades de los Gases, se expresa en litros. . El volumen de un gas depende de la presión y de la temperatura.
Volumen Molar
Es el volumen ocupado por una molécula de cualquier gas, medido en condiciones normales y su valor es igual a 22.4 litros
Hipótesis de Abogadro
Se refiere al número de moléculas que contienen los gases. Enunciado: ^Volúmenes iguales de cualquier gas, medidos en las mismas condiciones de presión y temperatura, siempre contienen igual numero de moléculas^. Ejemplo:
Número de Avogadro
Es el número de entidades elementales (átomos, moléculas, iones, etc.), que contienen una molécula de cualquier sustancia. 1 Mol = Cantidad de sustancia NA = 6,023 x 1023 entidades elementales Mol > Condición inicial y Final respecto Presión, volumen y Temperatura
Ley de Boyle - Mariotte (Isotérmica)
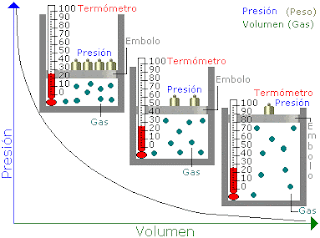 A temperatura absoluta, el volumen que ocupa una muestra de un gas, varía enferma inversamente proporcional a la presión que está sometido dicho gas." A, T y n constantes.
A temperatura absoluta, el volumen que ocupa una muestra de un gas, varía enferma inversamente proporcional a la presión que está sometido dicho gas." A, T y n constantes.
Manómetro
 Aparato. (Instrumento) destinado a medir la presión de los gases o vapores encerrados en determinados recipientes.
Aparato. (Instrumento) destinado a medir la presión de los gases o vapores encerrados en determinados recipientes.
Ley de Charles (Isobárica)
 "A presión constante, el volumen de la masa de un gas es directamente proporcional a su temperatura °K." V=kT --------) k=V/T V1 = V2 T1 T2
"A presión constante, el volumen de la masa de un gas es directamente proporcional a su temperatura °K." V=kT --------) k=V/T V1 = V2 T1 T2
Ley de Gay- Lussac (Isocórica)

A volumen constante, la presión de la m.asa de un gas. Varía en forma directamente proporcional con la temperatura absoluta” P=kT --------------) k=P/T P1 = P2 T1 T2
Ecuación General de los Gases Ideales
Es una fórmula que reúnen las tres leyes (Boyle, Charles y Cay Lussac), con esta ecuación se puede proveer lo que acontece al variar el volumen, la presión Es una Combinación de las tres leyes anteriormente dichas:
P1*V1=P2*V2 P1*V1=P2*V2 V1/T1=V2*T2 -----------)
V1*T2=V2*T1 P1/T1=P1*T2 P1*T2=P1*T1 2V1*2P1*2T2=2P2*2V2*2T1 ---------) V1*P1*T2=V2*P2*T1
Ecuación de Estado de los Gases Perfectos o Ideales
PV=nRT
Condiciones Normales
P= 1 Atm V=22.4 Litros N=1 mol T=273 grados Kelvin
R=P*V N*T R= 1 Atm*22.4 Litros 1Mol* 273 Grados Kelvin
R= 0.08205128205
Ley de Dalton o de las Presiones Parciales
La presión total ejercida por una mezcla de gases es igual a la suma de las presiones parciales de sus componentes." Presión Parcial. Es la presión de cada gas. PT=Pl+ P2+P3+ Pn PT = Presión total P1, P2, P3,.........Pn = Presiones parciales
Ley de Graham o de la Difusión Gaseosa
 La velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su densidad." r= 1/raíz cuadrada de d r = Velocidad de difusión d = Densidad Como en la práctica no es posible medir la difusión de un gas, sino respecto a Otro gas, entonces: La velocidad de difusión de dos gases es inversamente proporcional a la raíz cuadrada de la relación de sus pesos moleculares r1= Inicial . . r2= Final Como el peso. Molecular de un gas es directamente proporcional a su Densidad
La velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su densidad." r= 1/raíz cuadrada de d r = Velocidad de difusión d = Densidad Como en la práctica no es posible medir la difusión de un gas, sino respecto a Otro gas, entonces: La velocidad de difusión de dos gases es inversamente proporcional a la raíz cuadrada de la relación de sus pesos moleculares r1= Inicial . . r2= Final Como el peso. Molecular de un gas es directamente proporcional a su Densidad
Ley de Bunsen
A igual presión y temperatura los tiempos de salida de volúmenes iguales de dos gases por un oficio es directamente proporciona! a las raíces cuadradas de sus pesos moleculares o de sus densidades".
Densidad de los Gases
 La densidad de los gases es pequeña en comparación con los líquidos y sólidos Densidad Absoluta Es la relación entre, la masa y el volumen así gas en condiciones determinadas presión y temperatura. d=m/V PV=m/MRT
La densidad de los gases es pequeña en comparación con los líquidos y sólidos Densidad Absoluta Es la relación entre, la masa y el volumen así gas en condiciones determinadas presión y temperatura. d=m/V PV=m/MRT
Gases Reales
A presiones muy elevadas el espacio ocupado por las moléculas no es despreciable frente al espacio ocupado por el gas.
Ecuación de Van der Waals
Van der Waals demostró que la atracción intermolecular y el espacio ocupado por las mismas moléculas (con volumen) deben tomarse en cuenta para modificar la ecuación de estado. Para un mol de gas tenemos: Para n moles: Donde; a y b = constantes características de cada gas b = volumen intrínseco o con volumen de las moléculas = volumen = presión interna de las moléculas (fuerzas atractivas entre Moléculas que reducen el volumen y la presión). Problema: Calcular la presión que ejerce una. Mol de nitrógeno en un recipiente de 0.5 1 a'27° C, sabiendo que los valores de- las constantes son a = l, 390atm/ mol2; b = 0,03913 VmoL
Coeficiente de Compresibilidad (Z)
La relación entre presión, volumen y temperatura de los gases reales, Particularmente a alta presión y a baja temperatura se desvían apreciablemente de la ecuación del gas ideal. El comportamiento de un gas real se determina investigando la variación el coeficiente de compresibilidad en función de la presión. El coeficiente: PV=nZRT
Estado Líquido

Característica
Fuerza de expansión = Fuerza de cohesión
Propiedades
- Los espacios intermoleculares en los líquidos no existen.
- Las moléculas poseen movimientos, pero más restringidos que en los gases.
- Son incompresibles, es difícil disminuir el volumen por presiones externas
- Poseen volumen fijo, no varía al cambiar la capacidad del recipiente.
- Carecen de forma definida, adquieren la forma del recipiente que los contiene.
- Son medianamente difusibles.
Evaporación o Vaporización
 Todos los líquidos a cualquier temperatura tienden a pasar a la fase de vapor, esta propiedad se Denomina evaporación o vaporización. Este fenómeno se explica porque las moléculas en los líquidos están en contacto y moviéndose limitadamente a determinadas velocidades. Las moléculas de la superficie que no están sometidas a las fuerzas de atracción, en toda dirección ganan energía cinética para evaporar y pasar a la fase gaseosa (evaporación), la velocidad de evaporación depende de: - La temperatura - La presión - Superficie libre de líquido - Renovación de la atmósfera sobre la superficie libre del líquido. - Naturaleza química del líquido. Un líquido se evapora cuanta más alta sea la temperatura y cuanto mayor sea la superficie libre de evaporación Cuanto más débiles son las fuerzas .de atracción entre las partículas del líquido, mayor es la velocidad de evaporación. Por ejemplo: Un líquido no polar como la gasolina se evapora más rápidamente que un líquido polar como el agua a la misma temperatura.
Todos los líquidos a cualquier temperatura tienden a pasar a la fase de vapor, esta propiedad se Denomina evaporación o vaporización. Este fenómeno se explica porque las moléculas en los líquidos están en contacto y moviéndose limitadamente a determinadas velocidades. Las moléculas de la superficie que no están sometidas a las fuerzas de atracción, en toda dirección ganan energía cinética para evaporar y pasar a la fase gaseosa (evaporación), la velocidad de evaporación depende de: - La temperatura - La presión - Superficie libre de líquido - Renovación de la atmósfera sobre la superficie libre del líquido. - Naturaleza química del líquido. Un líquido se evapora cuanta más alta sea la temperatura y cuanto mayor sea la superficie libre de evaporación Cuanto más débiles son las fuerzas .de atracción entre las partículas del líquido, mayor es la velocidad de evaporación. Por ejemplo: Un líquido no polar como la gasolina se evapora más rápidamente que un líquido polar como el agua a la misma temperatura.
Presión de Vapor (Pv)
Si un líquido es colocado en un recipiente cerrado, las moléculas que escapan del 'líquido (evaporación) a la fase gaseosa, causan una presión en el recipiente. Después de un corto tiempo la velocidad a la cual las moléculas escapan del líquido es igual a la velocidad a la cual otras moléculas retoman, al líquido produciéndose el estado de equilibrio, el estado descrito anteriormente donde dos procesos ocurren simultáneamente (evaporación - condensación) se denomina equilibrio dinámico. Presión de Vapor "Es la presión que ejercen las moléculas gaseosas en el punió de equilibrio a Una temperatura determinada." Cuando aumenta la temperatura, también aumenta la presión de vapor. . Cuando menores sean las fuerzas de atracción entre las partículas, mayor será la presión de vapor. Para cualquier temperatura la presión de vapor de agua es menor que la presión de vapor del alcohol, como podemos observar en el siguiente gráfico:

Punto de Ebullición (Peb)
 Es la temperatura a la cual la presión de vapor del líquido es igual a la presión confinante (contigua), sí el recipiente está abierto, la presión confinante es igual a la presión atmosférica. El punto de ebullición de un. Líquido depende de la presión, a la que está sometido. A bajas presiones, el líquido hierve a menor temperatura y a presiones elevadas, el líquido hierve a mayor temperatura. Presión y Punió de Ebullición Ciudad Presión Punto de ebullición °C Quito, , 540 mmHg 91 Guayaquil 760ntmHg 100 Punto de Ebullición Normal de un Líquido Es la temperatura a la cual la presión de vapor es igual a una atmósfera. La temperatura de un líquido puro en ebullición se mantiene constante hasta que todo el líquido haya sido evaporado. El punto de ebullición puede ser modificado por la presencia de sustancias disueltas o presencia de burbujas. También varía con las fuerzas de atracción entre las partículas del líquido, las sustancias polares tienen puntos de ebullición más altos que las sustancias no polares. Las sustancia polares entre sí, cuanto más polar sea la sustancia, más elevado será el punto de ebullición normal. . Las sustancias no polares cuanto mayor sea el peso molecular, tanto más elevado será el punto de ebullición normal. : Por ejemplo: Una olla de presión cuando se cierra y se coloca al calor, en el interior del recipiente ejerce una presión en el espacio que le rodea al líquido, aumenta el punto de ebullición del agua, el alimento se cocina a mayor temperatura y más rápido.
Es la temperatura a la cual la presión de vapor del líquido es igual a la presión confinante (contigua), sí el recipiente está abierto, la presión confinante es igual a la presión atmosférica. El punto de ebullición de un. Líquido depende de la presión, a la que está sometido. A bajas presiones, el líquido hierve a menor temperatura y a presiones elevadas, el líquido hierve a mayor temperatura. Presión y Punió de Ebullición Ciudad Presión Punto de ebullición °C Quito, , 540 mmHg 91 Guayaquil 760ntmHg 100 Punto de Ebullición Normal de un Líquido Es la temperatura a la cual la presión de vapor es igual a una atmósfera. La temperatura de un líquido puro en ebullición se mantiene constante hasta que todo el líquido haya sido evaporado. El punto de ebullición puede ser modificado por la presencia de sustancias disueltas o presencia de burbujas. También varía con las fuerzas de atracción entre las partículas del líquido, las sustancias polares tienen puntos de ebullición más altos que las sustancias no polares. Las sustancia polares entre sí, cuanto más polar sea la sustancia, más elevado será el punto de ebullición normal. . Las sustancias no polares cuanto mayor sea el peso molecular, tanto más elevado será el punto de ebullición normal. : Por ejemplo: Una olla de presión cuando se cierra y se coloca al calor, en el interior del recipiente ejerce una presión en el espacio que le rodea al líquido, aumenta el punto de ebullición del agua, el alimento se cocina a mayor temperatura y más rápido.
Calor de Vaporización Calor específico
Cantidad de calor necesario para elevar la temperatura de una cantidad de sustancia determinada (kg) en un grado centígrado Generalmente se expresa en "calorías sobre gramo, es decir, se necesita cierta cantidad de calor para elevar la temperatura de -un gramo de sustancia en un grado centígrado. En el punto de ebullición de un líquido también necesita cierta cantidad de calor para convertir una cantidad de líquido en gas.
Calor de Vaporización
Es la cantidad de calor necesaria para convertir una cantidad de liquido a gas. Cuando el gas se condensa hacia el estado líquido se libera la misma cantidad de calor que fue necesaria para vaporizar el líquido, así cuando un gramo de vapor se condensa a agua líquida se liberan 540 calorías de calor, por esta razón se puede adquirir quemaduras severas al exponerse al vapor. Cuando el vapor se condensa en la piel, esta gran cantidad de vapor penetra en la piel ocasionando las quemaduras.

Punto de Fusion
Temperatura a la cual el sólido pasa a líquido
Punto de Congelación
Temperatura a la cual el líquido pasa a sólido. Cuando se congela el agua a 0° C habrá alguna cantidad constante de hielo y agua líquida si se mantiene constante la temperatura. La velocidad en el cual se derrite o se funde el hielo es igual a la velocidad cuando el agua se congela. Los puntos de fusión o congelación también dependen de las fuerzas de atracción entre las partículas, es decir, entre más fuertes sean las fuerzas de atracción que unen las partículas para constituir las formas definidas de un sólido, más alta es la temperatura para fundir un sólido. En general las sustancias covaleníes y las covalentes polares tienen puntos de fusión~más'altos que las sustancias covaleates no polares.
Calor de Fusión
Es la cantidad de calor necesario para convertir una cantidad determinada de un sólido a líquido en el punto de congelación (cantidad de energía necesaria para el cambio de estado en el punto de fusión) Sólido
Transformaciones de calor durante el cambio de un estado a otro.
 Explicación: - Se necesita cierta cantidad de energía para convertir una sustancia del estado sólido a líquido, en el punto de congelación (calor de fusión).
Explicación: - Se necesita cierta cantidad de energía para convertir una sustancia del estado sólido a líquido, en el punto de congelación (calor de fusión).
- Se necesita cierta cantidad de calor para elevar 1°C una cantidad de sustancia (calor específico).
- Se necesita cierta cantidad de calor para convertir una cantidad de líquido a gas en el punto de ebullición-(calor de vaporación).
Problemas: 1. Cuánto calor, en Kcal se requiere para convertir 50 g. de hielo a 0°C en vaporalOO°C Solución
Etapas: * Conversión de sólido a líquido a 0°C (Calor de Fusión) *
Aumento de Temperatura de (0-100)°C (Calor Específico)
* Conversión de líquido a gas a 100°C (Calor de Vaporización.)
TAPA 1: conversión de solidó a líquido a 0°C Del cuadro anterior, el calor de fusión del agua es 80,0 cal/g 50g *80/1 = 4000 cal == 4,00kcal 1S
ETAPA 2: aumento de temperatura de (O -100) °C 50g * (100-0) °C 1cal/1 g =5.000 cal- 5,00 Kcal
ETAPA 3: conversión de líquido a gas 50g 540/g= 27.000cal =27,0 K cal
Calor total = ETAPA 1 + ETAPA 2+ ETAPA 3 = (4,00 + 5,00 + 27) K cal Calor total = 36Kcal
Destilación
 Es un proceso de separación de líquidos, basado en las diferencias de sus punios de ebullición. Al calentar una mezcla, el líquido con el punto de ebullición más bajo hervirá primero y se separa de la mezcla (vapor). El vapor pasa a través del tubo del condensador donde es enfriado por agua que circula exterionnente, ocasionando la condensación del gas y pasando al estado líquido. La destilación se utiliza también para purificar el agua. El agua impura es calentada en un balón de destilación- El vapor de agua pura se forma y después de condensado se recoge. Las impurezas permanecen en el balón de destilación.
Es un proceso de separación de líquidos, basado en las diferencias de sus punios de ebullición. Al calentar una mezcla, el líquido con el punto de ebullición más bajo hervirá primero y se separa de la mezcla (vapor). El vapor pasa a través del tubo del condensador donde es enfriado por agua que circula exterionnente, ocasionando la condensación del gas y pasando al estado líquido. La destilación se utiliza también para purificar el agua. El agua impura es calentada en un balón de destilación- El vapor de agua pura se forma y después de condensado se recoge. Las impurezas permanecen en el balón de destilación.
Viscosidad
 Es la resistencia 'míeme que presentan las moléculas de un líquido difluir. Un líquido de alia viscosidad se describe como viscoso o espeso, lo inverso de la viscosidad es la fluidez. Un líquido fluido se describe como móvil. La viscosidad depende de la temperatura y la presión, disminuye con la temperatura y aumenta con.la presión. La viscosidad es una propiedad importante en la industria del petróleo/el empleo de un aceite depende de la viscosidad y de la manera como disminuye al aumentar la temperatura. La unidad de viscosidad es el (poise) pero se utiliza el (centipoíse). En la práctica se mide por el tiempo que tarda un volumen de un líquido en fluir por un orificio de un cierto radio. Los aparatos de medición se llaman viscosímetros.
Es la resistencia 'míeme que presentan las moléculas de un líquido difluir. Un líquido de alia viscosidad se describe como viscoso o espeso, lo inverso de la viscosidad es la fluidez. Un líquido fluido se describe como móvil. La viscosidad depende de la temperatura y la presión, disminuye con la temperatura y aumenta con.la presión. La viscosidad es una propiedad importante en la industria del petróleo/el empleo de un aceite depende de la viscosidad y de la manera como disminuye al aumentar la temperatura. La unidad de viscosidad es el (poise) pero se utiliza el (centipoíse). En la práctica se mide por el tiempo que tarda un volumen de un líquido en fluir por un orificio de un cierto radio. Los aparatos de medición se llaman viscosímetros.
Tensión Superficial
 Es la resistencia de las moléculas de los líquidos a cualquier fuerza que tiende a . expandir su superficie. Es la propiedad que tiende a halar las moléculas de la superficie de un líquido hacia su interior. Fenómeno causado por el hecho que dentro del líquido cada molécula es atraída por el resto de moléculas, pero las moléculas que se encuentran en la superficie . son atraídas hacia abajo. • Cuanto mayor sea la fuerza de atracción entre las partículas, mayor es la tensión superficial, por ejemplo el mercurio tiene mayor tensión superficial que el agua por sus fuertes atracciones moleculares (enlace metálico). Al aumentar la temperatura del líquido, disminuye la tensión superficial, por ejemplo: la acción limpiadora de los jabones se debe a la reducción de la tensión superficial del agua. Se puede atribuir varios fenómenos a la tensión superficial de los líquidos: Objetos pequeños de densidad poco elevada a la del agua, flotan y no son mojados; Formación de gotas de agua en el exíreaao de ua 'tubo (forma esférica). La fina capa de aceite que se forma sobre el agua. El ascenso capilar de un líquido. Resistencia que presentan ios líquidos a la ruptura de la superficie, etc. El método común usado para medir la tensión superficial de los líquidos se basa en la elevación capilar
Es la resistencia de las moléculas de los líquidos a cualquier fuerza que tiende a . expandir su superficie. Es la propiedad que tiende a halar las moléculas de la superficie de un líquido hacia su interior. Fenómeno causado por el hecho que dentro del líquido cada molécula es atraída por el resto de moléculas, pero las moléculas que se encuentran en la superficie . son atraídas hacia abajo. • Cuanto mayor sea la fuerza de atracción entre las partículas, mayor es la tensión superficial, por ejemplo el mercurio tiene mayor tensión superficial que el agua por sus fuertes atracciones moleculares (enlace metálico). Al aumentar la temperatura del líquido, disminuye la tensión superficial, por ejemplo: la acción limpiadora de los jabones se debe a la reducción de la tensión superficial del agua. Se puede atribuir varios fenómenos a la tensión superficial de los líquidos: Objetos pequeños de densidad poco elevada a la del agua, flotan y no son mojados; Formación de gotas de agua en el exíreaao de ua 'tubo (forma esférica). La fina capa de aceite que se forma sobre el agua. El ascenso capilar de un líquido. Resistencia que presentan ios líquidos a la ruptura de la superficie, etc. El método común usado para medir la tensión superficial de los líquidos se basa en la elevación capilar
Condensación
Es el proceso por el cuál el vspor posa {¡¡estado liquido. Inicialmente la velocidad de evaporación es mayor que la velocidad de condensación, después de un. tiempo disíaiauye la velocidad de evaporación y aumenta la velocidad de condensación.
Miscibilidad
Capacidad de los css.erpG-s (íssií.idos) para mezclarse entre si (mezclos homogéneas), •••... Esto significa que se disuelven el uno ea el otro líquido. Es posible mezclar en cualquier proporción, y pemaaaecea mezclados sis separarse ea capas. Por ejemplo: El agua y ei alcoliol. -
Inmiscibilidad
Capacidad de los cuerpos (liquidos) pera no mezclarse entre si (mezclas heterenogeneas). Cuando se agitan junios, dos líquidos miscibles forman una mezcla turbia que contiene gotas pequeñísimas de uno de ellos visiblemente suspendidas en el. otro líquido, al dejar en reposo;, los líquidos miscíbles se separan en dos capas distintas Por ejemplo:El aceite vegetal y el agua son inmiscibles, en el frasco de la izquierda, el aceite vegetal y el agua se mezclan al agitarlos vigorosamente. En el frasco de la derecha al estar en reposo forman capaz separadas, con el aceite en la parte superior y el agua en la parte inferior por la diferencia de densidades
Estado Sólido
 Característica
Característica
Fuerzas de expansión < .las fuerzas de cohesión.
Propiedades
- Carecen de espacios intermoleculares, sus moléculas están muy unidas
- Las moléculas no poseen movimiento
- Son incompresibles, no disminuye el volumen por presiones extemas
- Poseen volumen fijo
- Poseen forma definida
- Los sólidos se difunden o se mezclan con gran dificultad
Clasificación de los Sólidos
Los sólidos por su estructura se clasifican en: Sólidos de estructura amorfa o vitrea Sólidos de estructura cristalina
Sólidos de Estructura Amorfa o Vitrea
Los constituyentes (partículas, moléculas, átomos o iones) se encuentran distribuidos sin seguir ningún ordenamiento geométrico, son considerados como líquidos dotados de gran viscosidad, por ejemplo: vidrio, plástico, resinas. Estos sólidos carecen de punto de fusión definido y en su lugar presentan temperaturas de reblandecimiento, por ejemplo: el vidrio se reblandece desde los 400° C a los 800° C.
Sólidos de Estructura Cristalina
Los constituyentes (partículas, moléculas, átomos o iones) tienen ordenamiento geométrico (figuras conocidas) Estos sólidos presentan propiedades físicas diferentes a las de los sólidos amorfos. Los sólidos de estructura cristalina forman poliedros llamados cristales., Cristal Es una figura geométrica representativa (poliedro), considerado como la unidad de los sólidos cristalinos.
Elementos de un cristal
Elementos morfológicos o reales Elementos de simetría o imaginarios. Elementos
Morfológicos o Reales
Caras: Superficies planas que limitan al cristal Aristas: Líneas formadas por la interacción de dos caras. Vértices: Puntos que se forman en la intersección de dos p más caras. Ángulo diedro: Ángulo formado por dos caras Angulo poliedro ó sólido: Ángulo formado por tres o más caras.
Elementos de Simetría o Imaginarios
Centro de Simetría: Pimío imaginario situado en el centro de la figura geométrica y divide en partes iguales todo elemento que pase por él. Ejes de Simetría: Son rectas imaginarias que pasando por el centro, de simetría pueden terminar en los vértices, en el centro de las caras o en la mitad de las aristas. Plano de Simetría: Superficies planas que dividen en dos partes iguales al cristal.
Clasificación de los cristales
Los sólidos cristalinos que existen en la naturaleza han sido reunidos en 32 figuras geométricas diferentes, los mismos que a su vez han sido clasificados .V" . en 6 grupos, las figuras semejantes o parecidas, por ejemplo: el tetraedro, octaedro, decaedro, dodecaedro, son agrupadas para formar el sistema cúbico o regular. La clasificación en 6 sistemas cristalográficos se basa en la longitud relativa de los ejes y en su inclinación de los mismos,
1. Sistema cúbico o regular
Tiene como figura representativa al cubo y se caracteriza por poseer los 3 ejes-de igual longitud y perpendiculares entre si, por ejemplo: el diamante, la pirita, cloruro de sodio
2. Sistema Tetragonal o Cuadrático
Tiene como figura representativa al prisma recto de base cuadrada y se caracteriza por poseer dos ejes de igual longitud y uno de diferente longitud. Todos los ejes son perpendiculares entre si, por ejemplo: sulfato de sodio, el indio, casiterita.
Polimorfismo
Fenómeno por el cual la misma sustancia química puede cristalizarse en más de un sistema, por ejemplo: el carbono, cuando se encuentra como diamante, cristaliza en el sistema cúbico y cuando se encuentra como grafito cristaliza en el sistema hexagonal, por lo tanto es una sustancia dimorfa.
Transformación de los Estados Físicos de la Materia"
Son transformaciones que sufre la materia al pasar de un estado físico a otro por pérdida o ganancia de calor.

Fusion
Es el cambio de estado de sólido a líquido, por aumento o ganancia de calor.
Evaporación
Es el cambio de estado de líquido a gaseoso, por aumento o ganancia de calor. Condensación
Es el cambio de estado sólido a líquido, por perdida o disminución de calor. Solidificación ó Congelación Es el cambio del estado líquido a sólido, por perdida o disminución de calor. Sublimacion
Es el cambio de estado sólido a gaseoso en forma directa, por aumento o ganancia de calor, por ejemplo; hielo seco, Retrosublimacion o Cristalización
Es el cambio de estado gaseoso a sólido por disminución de calor.
Diagrama de Fases
Es la representación gráfica que resume las relaciones existentes entre los estados: Gaseoso, líquido y sólido de una sustancia en función, de la temperatura y la presión. Cada sustancia tiene su propio diagrama de fases obtenido con datos experimentales.
No hay comentarios:
Publicar un comentario